欧盟MDR下的新指南
医疗器械协调小组(MDCG)根据医疗器械法规(MDR)和体外诊断器械法规(IVDR)发布了两个新的指导文件。这些涉及新的医疗器械法规(MDR)所要求的“负责法规遵从的人员”和“植入卡”。
这些是MDCG发布的最新指南,并在该法规于2020年5月(对于医疗器械)和2022年5月(对于体外诊断医疗器械)生效之前在欧洲委员会的网站上整理。
监管合规负责人
根据MDR的第15条和IVDR的第15条,“ 制造商应在其组织内至少配备一名负责监管合规的人员,这些人员具有医疗设备领域的必要专业知识。”虽然法规对医疗器械的要求做出了规定。在PRRC和自己的责任的概述的资格,在指导增加了额外的细节,这些要求,并明确了制造商PRRC要求及授权代表(AR),尤其是:
每个合法制造商都必须拥有PRRC可供使用,并且如果组织中有多个合法制造商,则每个制造商都必须拥有自己的PRRC。该指南并未阐明同一PRRC是否可以为多个制造商提供服务。
未在欧盟成立的制造商必须在欧盟成员国内拥有AR,而后者还必须具有PRRC。AR还可以将PRRC的职责分包给第三方。制造商和AR的PRRC不能是一个人,对于小型或小型企业,制造商的PRRC和AR的PRRC不能来自同一外部组织。
就位置而言,PRRC应与制造商或AR位于同一地点。因此,如果制造商位于欧盟以外,则PRRC也应位于欧盟以外。欧盟的制造商也应在欧盟内部设有PRRC。由于AR将位于欧盟内,因此PRRC也将位于欧盟内。
如果PRRC的要求资格未在欧盟获得,则应由欧盟成员国认可,等同于欧盟相应的资格。
微型或小型企业可以将PRRC的责任分包给第三方,但前提是PRRC具有相关资格,并且制造商可以证明他们能够使用非制造商组织内的第三方来履行其法律义务。
请注意,该指南并未提及制造商或PRRC可能承担的违反PRRC责任或两个实体之间关系的潜在责任。这可以在国家执行耐多药和IVDR中解决。但是,这种不清晰会影响公司为MDR做准备。
植入卡
根据MDR第18条,可植入设备的制造商应向该设备提供植入卡(IC),以允许识别该设备以及其他关键信息。此外,会员国应要求医疗机构将某些信息作为IC的一部分提供。尽管MDR中包含了IC的预期目的和许多必需的元素,但是IC 指南更进一步,包括数据元素的更多详细信息,并提供了应如何显示此信息的示例。
根据MDR,制造商必须随IC提供以下信息:
2.序列号,批号;
3.唯一设备标识(UDI);
4.制造商的名称,地址和网站;
5.设备类型。
该信息最好应在卡本身上,或作为临床医生要粘贴的标签,尽管在指南中不建议这样做。IC还应包含空白字段,以供医疗保健提供者填写以下信息:
1.患者姓名或患者ID;
2.进行植入的医疗机构的名称和地址;
3.植入日期。
IC的尺寸应为信yong卡尺寸,该指南还建议您使用符号以避免使用IC的国家版本,并包含可用于某些数据字段的经过验证的符号列表。建议使用说明手册以相关成员国的语言解释符号。最后,它建议了植入卡和相应传单的一些设计。以下是指南中提供的许多示例之一:
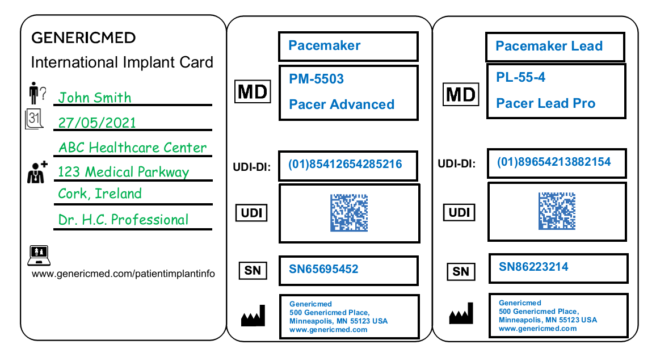
这些实际示例至少在MDR的这一方面可能会为公司提供急需的清晰度,并且将成为有助于IC设计和生产的有用工具。









